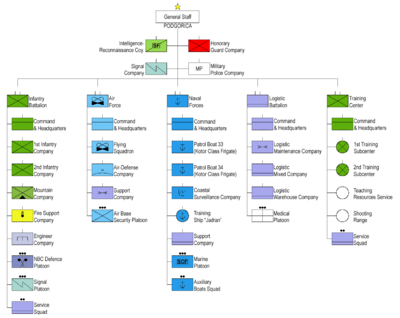
Saites, saites, saites?
saturs
Tikšanās ar elektroķīmiju 5. daļa
Iepriekšējo tikšanos laikā mēs esam redzējuši daudzus galvanisko elementu piemērus - tos, kuriem ir tikai vēsturiska nozīme, un citus, kas tiek izmantoti mūsdienās. Šūnu pasaule ir ļoti bagāta, tāpēc ir pienācis laiks ieviest sistēmas, kas atšķiras no līdz šim parādītajām.
Nemetāli var būt arī pusšūnas
Pirmkārt, eksperiments, kurā nepieciešami divi grafīta elektrodi no izlietotiem Leclanchet elementiem, cinka bromīda ZnBr2, barošanas avots (piemēram, 4,5 V akumulators) un neaizstājams sprieguma mērītājs. Mājas laboratorijā, protams, neatradīsim ieteicamo cinka sāli, bet mūsu gadījumā tas tiks veiksmīgi aizstāts ar kālija bromīda KBr un cinka sulfāta (VI) ZnSO maisījumu.4. Saliekam komplektu, kas sastāv no divām grafīta nūjām, piestiprinām pie tāfeles tā, lai elektrodi būtu daļēji iegremdēti stiklā.
Pie elektrodiem pievienojam vadu gabalus, vēlams ar lodāmuru (tāpēc, noņemot tos no vecā akumulatora, uz grafīta stieņiem atstājiet misiņa “vāciņus”). Izgatavosim arī diafragmu no kartona gabala ar izmēriem, kas pielāgoti vārglāzei ar ietilpību 50-100 cm.3 (kartonu var papildus caurdurt ar tapu).
Tagad daļu no minētajiem sāļiem izšķīdinām ūdenī, un tad piepildām glāzi ar sagatavoto šķīdumu (koncentrācija 5-10%). Novietojiet statīvu ar elektrodiem uz trauka malas un pievienojiet vadu galus plakanā akumulatora misiņa plāksnēm (polaritātei šobrīd nav nozīmes) un novērojiet uzbūvēto sistēmu.
Gandrīz nekavējoties uz elektroda, kas savienots ar akumulatora negatīvo spaili, tiek uzklāts sudrabaini pelēks spīdīgs slānis. Izgatavots no metāliska cinka. Blakus otrajam elektrodam, kas savienots ar akumulatora pozitīvo polu, ir redzama šķīduma dzeltenīgi brūna krāsa. Brīvais broms ir iekrāsots pie grafīta stieņa. Pēc aptuveni 5 minūtēm atvienojiet vadus no akumulatora spailēm. Izmantojot voltmetru, izmēra spriegumu (skaitītāja "mīnuss" ir savienots ar elektrodu, kas pārklāts ar metāla slāni).
Neiedziļinoties elektrolīzes laikā notiekošajos procesos (tos apspriedīsim kādā no nākamajām sanāksmēm), varam secināt, ka izveidotā šūna sastāv no diviem elektrodiem: cinka (Zn šķīdumā uz grafīta nogulsnēts metāla cinks2+) un broms (broma un bromīda Br brīvo jonu šķīdums?). Ogleklis ir tikai elektrības vadītājs (praksē par elektrodu materiāliem bieži izmanto noteiktos apstākļos nereaģējošas vielas, piemēram, grafītu, platīnu).
Savienosim strāvas uztvērēju ar elektrodiem? spuldze ar darba spriegumu 1,5 V (šajā gadījumā arī savienojumu polaritātei nav nozīmes). Kad enerģija tiek iegūta no sistēmas, mēs novērojam pakāpenisku metāla nogulsnes pazušanu uz viena elektroda un dzeltenīgu krāsu uz otra. Iepriekš izdalītās vielas reaģē, atjaunojot sākotnējo stāvokli. Reakcija ir netieša ar elektronu pārnesi caur savienojošo vadu. Tāda ir galvanisko elementu būtība.
Kādas reakcijas notika mūsu sistēmā? Cinka elektrodam mēs noteikti varam sniegt procesa vienādojumu:
(-) Zīmogs0 ? cinks2+ +2e-
Otrajā elektrodā brīvais broms tiek reducēts par broma anjoniem:
(+) Nē.2 +2e- , 2Br-
Tādējādi šūnu shēma ir šāda (izlaižam kālija un sulfāta (VI) jonus, kas nepiedalās reakcijās):
(-) С, Zn | ZnBr2aq? ZnBr2aq | C (+)
Mums nav jāizmanto apertūra šūnā. Tomēr tā izmantošana neļaus bromam migrēt pie cinkota elektroda un tieši reaģēt starp šūnām.
Nemetāli veido pusšūnas kā metāliskus elementus. Ir nepieciešams tikai izmantot atbilstošā šķīdumā iegremdētu vadītāju, kas piedalīsies elektronu pārnesē. Halogēniem standarta potenciāli ir šādi (elektroda reakcija ir līdzīga tai, kas norādīta bromam):
| Puse šūna | F2/F? | Cl2/ Cl? | Br2/ Br? | I2/I? |
| E0 [V] | + 2,87 | + 1,36 | + 1,07 | + 0,54 |
Fluora gadījumā potenciālā vērtība (lielākā no visām noteiktajām pusšūnām) tika aprēķināta, nevis mērīta. Iemesls, tāpat kā sārmu un sārmzemju metālu gadījumā, ir aktīvā elementa reakcija ar ūdeni.
redoksšūna
Nākamajam eksperimentam sagatavosim šādus šķīdumus: dzelzs (III) hlorīds, FeCl3 ar koncentrāciju 5%, kālija jodīda KI ar koncentrāciju 10% un ūdens-cietes suspensiju. Sajauc dažus cm mēģenē3 sāls šķīdumus un pēc kāda laika pievieno dažus pilienus cietes suspensijas. Satura tumši zilā krāsa norāda uz brīvā joda klātbūtni. Reakciju raksta ar vienādojumu:
2 Fe3+ + 2i- ? 2Fe2+ + es2
dzelzs (III) katjoni oksidē jodīda anjonus par brīvu elementu, reducējot līdz dzelzs (II) joniem.
Cietes indikatora krāsas maiņa apstiprināja joda daļiņu klātbūtni, bet vai Fe katjoni patiešām ir izveidojušies?2+? Pārbaudīsim šo hipotēzi. Raksturīgs tests dzelzs(II) katjonu noteikšanai ir reakcija ar kālija heksacianoferātu(III) K3[Fe(CN)6], ko parasti sauc par kālija fericianīdu. Savienojums veido sarkanus kristālus, atšķirībā no tāda paša nosaukuma kālija ferocianīda (kālija (II) heksacianoferāts K4[Fe(CN)6]) ar dzelteniem kristāliem ? nejauksim šīs abas attiecības. Mēs atkārtojam iepriekšējo eksperimentu, bet cietes suspensijas vietā pievienojam dažus pilienus 1% kālija fericianīda šķīduma. Atkal reakcijas trauka saturs kļūst tumši zils, pateicoties sarežģītai kombinācijai, ko sauc par Tērnbula zilo:
3 Fe2+ + 2 [Fe (CN)6]3- ? Ticība3[Fe(CN)6]2
Es iesaku neticīgajiem veikt pārbaudi ar dzelzs un dzelzs sāļiem. Mēs iegūstam zilu nokrāsu tikai pirmajā gadījumā.
Tagad divās mazās vārglāzēs ar ietilpību 50-100 ml ielej vairākus dzelzs (III) hlorīda un kālija jodīda šķīdumus.3. Katrā no traukiem iegremdējiet grafīta elektrodu ar piestiprinātu stiepli (novietojiet uz piemērota statīva, lai tas neiekristu stiklā). Pievienojiet arī nedaudz cietes suspensijas traukā ar kālija jodīda šķīdumu. Lai izveidotu šūnu, būs nepieciešama arī elektrolītiskā atslēga (izgatavota vienā no iepriekšējām tikšanās reizēm? Pietiek ar blotpapīra sloksni, kas samērcēta koncentrētā KNO šķīdumā.3). Elektrodu vadu galus savieno ar universālā skaitītāja spailēm, kas uzstādītas sprieguma mērīšanai.
Mēs paši nosakām voltmetra savienojumu polaritāti, pamatojoties uz dzelzs (III) katjonu reakcijas vienādojuma ar joda anjoniem analīzi, atzīmējam, kurus no joniem tie dod un kuri saņem elektronus. Skaitītāja rādījumi apstiprina galvaniskā elementa darbību. Pēc tam mēs pārslēdzam ierīci uz pašreizējo mērījumu. Tas ir mazs (vairāku desmitu mA), tāpēc mums nav jāizmanto papildu uztvērējs (piemēram, spuldze), lai aizsargātu ierīci no bojājumiem. Tumši zilas krāsas veidošanās ap elektrodu, kas iegremdēts vārglāzē ar kālija jodīda šķīdumu, liecina par reakcijas gaitu sistēmā. Kad mēs pievienojam nedaudz kālija fericianīda šķīduma dzelzs (III) sāls kratītājam? arī tajā. Pierakstīsim brillēs notiekošo procesu vienādojumus:
(-)2I- ? 2 +2e-
(+)2Fe3+ +2e- ? 2Fe2+
un šūnu diagramma:
(-) Ar | CIaq || FeCl3aq | C (+)
Šūnā notiek tādas pašas reakcijas kā pēc substrātu sajaukšanas mēģenē (pietiek pievienot anodisko un katoda procesus pa sāniem), un transformāciju telpiskā atdalīšana ļauj izmantot pārnesto elektronu enerģiju. starp šūnas pusēm.
Šūnu, kuru mēs veidojam, sauc par redoksšūnu. Nosaukums ir izplatīts, bet maldinošs. Galu galā mēs zinām, ka oksidācijas un reducēšanas procesi notiek katrā saitē. Kā noteikt redoksreakcijas virzienu (tiek veikta gan šūnā, gan mēģenē)? Metode ir vienkārša:
1. Vai fizikālajās un ķīmiskajās tabulās atrodam atbilstošo pusšūnu standartpotenciālus? Fe sistēmai3+/ Ticība2+ tas ir +0,77 V; prieks manis2/I?: +0,54V.
2. Sistēma ar lielāku potenciālu ir oksidētājs reakcijā (šūnu katods), un pusšūna ar mazāku potenciālu? šūnas anods, t.i., reducētājs.
3. Tomēr jāatceras, ka sistēmām ar nelielām standarta potenciālu vērtību atšķirībām dažos gadījumos lomas var mainīt (faktiskie potenciāli, cita starpā, ir atkarīgi no reaģentu koncentrācijas).
Degvielas šūna
Mēs saliksim sistēmu no pirmā eksperimenta, aizstājot tikai kālija bromīda un cinka (VI) sulfāta šķīdumu ar 10% sērskābes (VI) H šķīdumu2SO4. Pēc 1-2 minūšu elektrolīzes (notiek ar gāzes izdalīšanos uz elektrodiem) izslēdziet barošanas avotu un uzmanīgi, lai no grafīta virsmas nenoņemtu gāzes burbuļus, izmēra spriegumu ar voltmetru. Saite izveidota! Pēc ierīces pārslēgšanas uz strāvas mērīšanas režīmu, reakcijas laikā var novērot gāzes burbuļu pazušanu uz grafīta elektrodu virsmas. Neiedziļinoties detaļās par procesu, kas izraisīja brīvā skābekļa un ūdeņraža nogulsnēšanos uz elektrodiem, reakcijas šūnā ir šādas:
(-)2H2? 4 stundas+ +4e-
(+)2 + 4H+ +4e- ? 2h2O
Kopumā notiek ūdens sintēzes reakcija no elementiem.

Konstruētā sistēma ir kurināmā elementa modelis. Degvielas un oksidētāja reakcijas enerģijas tieša pārvēršana elektroenerģijā ir ārkārtīgi izdevīga no procesa ekonomijas viedokļa? Nav nepieciešams pārvērst sadegšanas siltumu tvaika enerģijā, kas tikai darbina turbīnas. Nav pārsteidzoši, ka šādas sistēmas ir paredzētas enerģijas problēmu risināšanai (un atkritumi ir tīrs ūdens). Tomēr galvenais šķērslis ir būvmateriālu cena un nepieciešamība ražot ūdeņradi.
Lai gan kurināmā elementi ir izmantoti elektroenerģijas ražošanai tehnoloģiski vismodernākajās jomās, piemēram, lidojumos kosmosā (dažās nozarēs izmaksām ir sekundāra nozīme), to vēsture ir ļoti gara. Pirmo darbojošos ūdeņraža-skābekļa šūnas prototipu uzbūvēja britu izgudrotājs Viljams Roberts Grovs 1839. gadā.
Rakstā ir sniegti vairāki saišu veidi, kas atšķiras no iepriekšējās sanāksmēs apspriestajām. Tāpat kā pārējās epizodes? ir iezīmētas tikai šo sistēmu problēmas, kas ir svarīgas ne tikai kā enerģijas avots. Tomēr nepieciešamība saglabāt saprātīgu teksta izmēru neļauj apspriest daudzas interesantas tēmas, kas saistītas ar saitēm (ieinteresētos lasītājus aicinu meklēt informāciju pašiem). Nākamajā cikla epizodē mēs analizēsim pusšūnu potenciālu tabulu. Būs arī interesantas pieredzes piedāvājumi.
elektroniskā pieteikšanās
redoksšūna
Katra elektroķīmiskā šūna tiek pakļauta oksidācijai (pie anoda) un reducēšanās (pie katoda). Tomēr ķīmiskajā žargonā redoks šūnas tiek sauktas par noteikta veida sistēmu.
Eksperimentam nepieciešami kālija jodīda KI un dzelzs (III) hlorīda FeCl šķīdumi.3 un cietes ūdens suspensija (kartupeļu milti). Jums būs nepieciešama arī elektrolītiskā atslēga, kas piepildīta ar koncentrētu kālija nitrāta (V) KNO šķīdumu.3. Ja mums nav atslēgas, pietiek vairākas reizes salocīt salvešu papīra sloksni vai kālija nitrāta šķīdumā samērcētu kokvilnas pavedienu.
Kā elektrodus izmantosim grafīta stieņus no lietotām Leclanche šūnām (foto 1). Savienojiet elektrodu galus ar stiepli un iegremdējiet tos vārglāzēs ar KI šķīdumiem (pievienojot cietes vircu) un FeCl.3. Papildus mēs kombinējam šķīdumus glāzēs ar elektrolītisko atslēgu vai kādu no tās aizstājējiem (foto 2). Pēc kāda laika glāzē ar kālija jodīda šķīdumu (foto 3) sāk parādīties purpursarkanas svītras, pakāpeniski iekrāsojot trauku tumšā krāsā (4. un 5. fotoattēls). Tas ir raksturīgs brīvo joda molekulu un cietes molekulu kombinācijas produkts. Jods veidojās jodīda anjonu oksidēšanās rezultātā pie šūnas anoda:
(-) Anods: 2I- ? 2 +2e-
Pie otrā elektroda (katoda) tika reducēti dzelzs (III) joni:
(+) Katoda: 2Fe3+ +2e- ? 2Fe2+
Eksperimentā izveidotajai redoksšūnai ir šāda shēma:
(-) C | CIaq || FeCl3aq | C (+)
kur oglekļa simbols C apzīmē grafīta elektrodu un || ? elektrolītiskā atslēga. Vispārējā reakcija sistēmā ir anjonu oksidēšana I- ar Fe katjoniem3+:
2 Fe3+ + 2i- ? 2Fe2+ + es2
redoksšūna
koncentrācijas šūna
Otrajam eksperimentam jums būs nepieciešams: vara sulfāta (II) CuSO šķīdums4, vara elektrodi, elektrolītiskā atslēga piepildīta ar koncentrētu kālija nitrāta (V) KNO šķīdumu3 un universāls skaitītājs. Piepildiet vienu no vārglāzēm ar CuSO šķīdumu.4un otru ar tādu pašu atšķaidījumu 1:100 (piemēram, 0,5 cm3 šķīdumu, kas ņemts no pirmās glāzes, pievieno ūdeni līdz 50 cm tilpumam3) (6. fotoattēls). Pēc vara vadu iegremdēšanas glāzēs un ķēdes aizvēršanas ar elektrolītisko atslēgu, izmēra spriegumu starp šūnas elektrodiem. Tas ir mazs? apmēram duci vai vairākus desmitus milivoltu (7. foto).
Uz elektrodiem notiek vara šķīdināšanas un izgulsnēšanās reakcijas:
(-) Anods: Cu0 ? Ar2+ +2e- (mazāk koncentrēts šķīdums)
(+) Katods: Cu2+ +2e- ? Ar0 (koncentrētāks šķīdums)
Saskaitot abu elektrodu procesu vienādojumus, izrādās, ka ķīmiskā reakcija kopumā nenotiek! Šūnas dzinējspēks ir tikai sistēmas vēlme izlīdzināt koncentrācijas abās glāzēs.