Kā darbojas litija jonu akumulators elektriskajam transportlīdzeklim?
Apskatot citā rakstā visas automašīnas aprīkotas svina akumulatora darbību, tagad aplūkosim elektromobiļa un jo īpaši tā litija akumulatora darbības principu ...

Princis
Tāpat kā jebkura veida akumulatoriem, princips paliek nemainīgs: proti, ražot enerģiju (šeit elektrību) ķīmiskas vai pat elektriskās reakcijas rezultātā, jo ķīmija vienmēr ir blakus elektrībai. Faktiski paši atomi ir izgatavoti no elektrības: tie ir elektroni, kas griežas ap kodolu un kas kaut kādā veidā veido atoma "apvalku" vai pat tā "ādu". Zinot arī to, ka brīvie elektroni ir lidojoši ādas gabali, kas pavada savu laiku, pārvietojoties no viena atoma uz otru (nepiestiprinoties pie tā), tas ir tikai vadošu materiālu gadījumā (atkarīgs no elektronu slāņu skaita un elektronu skaita uz pēdējo šāviņu).
Pēc tam mēs ķīmiskās reakcijas laikā no atomiem paņemam "ādas gabalu" (tātad daļu no tā elektrības), lai iegūtu elektrību.

pamati
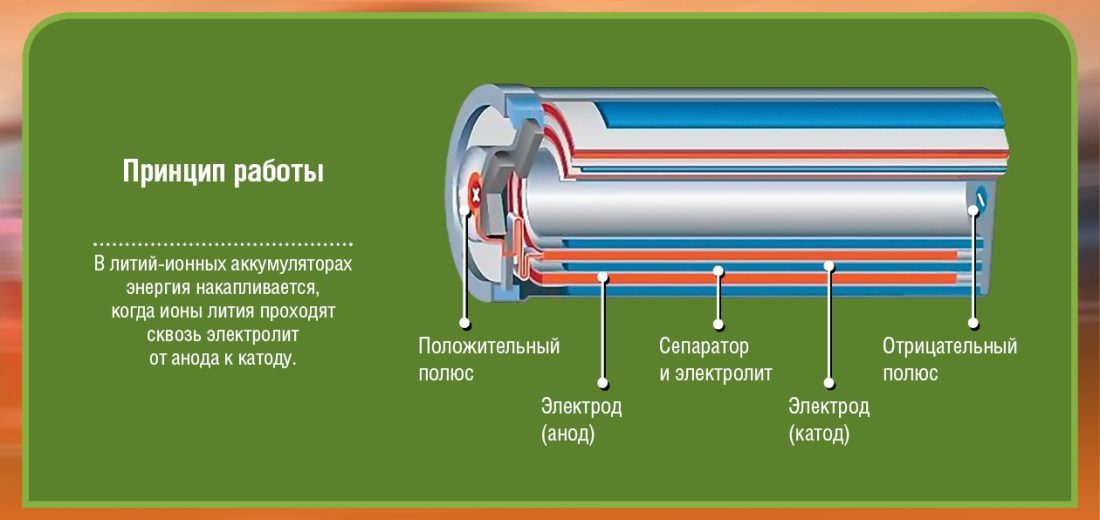
Pirmkārt, ir divi stabi (elektrodi), kurus mēs saucam katods (+ terminālis: litija-kobalta oksīdā) un anoda (terminālis -: ogleklis). Katrs no šiem poliem ir izgatavots no materiāla, kas novirza elektronus (-) vai piesaista (+). Viss ir applūdis elektrolīts kas padarīs iespējamu ķīmisku reakciju (materiāla pārnešanu no anoda uz katodu) elektroenerģijas ģenerēšanas rezultātā. Starp šiem diviem elektrodiem (anodu un katodu) ir ievietota barjera, lai izvairītos no īssavienojumiem.
Lūdzu, ņemiet vērā, ka akumulators sastāv no vairākām šūnām, no kurām katru veido diagrammās redzamais. Ja es, piemēram, uzglabāju 2 2 voltu elementus, man akumulatora izvadā būs tikai 4 volti. Lai iedarbinātu automašīnu, kas sver vairākus simtus kg, iedomājieties, cik daudz šūnu ir nepieciešams ...
Kas notiek poligonā?
Labajā pusē ir litija atomi. Tie ir parādīti detalizēti, ar dzelteno sirdi apzīmē protonus un zaļo sirdi apzīmē elektronus, ap kuriem tie riņķo.
Kad akumulators ir pilnībā uzlādēts, visi litija atomi atrodas anoda (-) pusē. Šos atomus veido kodols (sastāv no vairākiem protoniem), kura pozitīvais elektriskais spēks ir 3, un elektroni, kam ir negatīvs elektriskais spēks 3 (kopā 1, jo 3 X 3 = 1). ... Tāpēc atoms ir stabils ar 3 pozitīvajiem un 3 negatīvajiem (tas nepiesaista un nenovirza elektronus).
Mēs atdalām elektronu no litija, kas izrādās tikai ar diviem: tad tas tiek piesaistīts + un iet caur nodalījumu.
Kad es izveidoju kontaktu starp + un - spailēm (tātad, kad izmantoju akumulatoru), elektroni pārvietosies no - spailes uz + spaili pa elektrisko vadu ārpus akumulatora. Tomēr šie elektroni nāk no litija atomu "matiem"! Būtībā no 3 apkārt griežamajiem elektroniem 1 ir norauts un atomam paliek tikai 2. Pēkšņi tā elektriskais spēks vairs nav līdzsvarots, kas arī izraisa ķīmisku reakciju. Ņemiet vērā arī to, ka litija atoms kļūst litija jons + jo tagad tas ir pozitīvs (3 - 2 = 1 / Kodols ir 3 vērts un elektroni ir 2, jo mēs zaudējām vienu. Saskaitot iegūst 1, nevis 0 kā iepriekš. Tātad tas vairs nav neitrāls).
Ķīmiskā reakcija, kas rodas nelīdzsvarotības dēļ (pēc elektronu sadalīšanas, lai radītu strāvu), izraisīs nosūtīšanu litija jons + uz katodu (termināls +) caur sienu, kas paredzēta, lai visu izolētu. Galu galā elektroni un joni + nonāk + pusē.
Reakcijas beigās akumulators ir izlādējies. Tagad ir līdzsvars starp + un - spailēm, kas tagad novērš elektrību. Būtībā princips ir izraisīt depresiju ķīmiskā/elektriskā līmenī, lai radītu elektrisko strāvu. Mēs to varam uzskatīt par upi, jo vairāk tā nogāzēsies, jo svarīgāka būs plūstošā ūdens intensitāte. Savukārt, ja upe ir plakana, tā vairs netecēs, un tas nozīmē, ka akumulators ir izlādējies.
Uzlādēt?
Uzlādēšana sastāv no procesa apvērsuma, ievadot elektronus noteiktā virzienā, un vairāk atdalot ar sūkšanu (tas ir mazliet kā upes ūdens papildināšana, lai atkal izmantotu tās plūsmu). Tādējādi viss akumulatorā tiek atjaunots tā, kā tas bija pirms tā izlādēšanās.
Pamatā izlādējoties izmantojam ķīmisko reakciju un uzlādējot atdodam oriģinālās lietas (bet tam vajag enerģiju un līdz ar to arī uzlādes staciju).
Valkāt?
Litija akumulatori nolietojas ātrāk nekā vecie labie svina skābes akumulatori, kas mūsu automašīnās izmantoti gadsimtiem ilgi. Elektrolītam ir tendence sadalīties, tāpat kā elektrodiem (anodam un katodam), taču jāņem vērā arī tas, ka uz elektrodiem veidojas nogulsnes, kas samazina jonu pārnešanu no vienas puses uz otru ... Īpašas ierīces ļauj atgūt izlietotās baterijas, tās īpašā veidā izlādējot.
Iespējamo ciklu skaits (izlāde + pilna uzlāde) tiek lēsts aptuveni 1000-1500, tā ka ar pusciklu uzlādējot no 50 līdz 100%, nevis no 0 līdz 100%. SILDĒŠANA arī nopietni bojā litija jonu akumulatorus, kas mēdz sakarst, kad tie patērē pārāk daudz enerģijas.
Skatiet arī: Kā es varu ietaupīt akumulatoru savā elektriskā automašīnā?
Dzinēja jauda un akumulators...
Atšķirībā no termokameras, degvielas tvertne neietekmē jaudu. Ja jums ir 400 ZS dzinējs, tad 10 litru tvertne neļaus jums iegūt 400 ZS, pat ja tas ir ļoti īsu laiku ... Elektriskajam transportlīdzeklim tas nav tas pats! Ja akumulators nav pietiekami jaudīgs, dzinējs nespēs darboties ar pilnu jaudu... Tā tas ir ar dažiem modeļiem, kur dzinēju nekad nevar nospiest līdz galam (izņemot gadījumus, kad īpašnieks knibina un pievieno lielu kalibru akumulators!).
Tagad noskaidrosim: kā darbojas ELEKTRISKAIS MOTORS
Visi komentāri un reakcijas
Dernier publicēts komentārs:
mao (Datums: 2021. gads, 03:03:15)
ļoti labs darbs
Il I. 1 reakcija uz šo komentāru:
- Admin VIETNES ADMINISTRATORS (2021-03-03 17:03:50): Šis komentārs ir vēl labāks 😉
(Jūsu ziņa būs redzama zem komentāra pēc verifikācijas)
Rakstīt komentāru
Kā jūs jūtaties par ražotāju deklarētajiem patēriņa rādītājiem?
